بطارية
بطارية كهربائية
يب الأيبونيت (Ebonite) أو الشمع الأحمر بقطعة قماش من الصوف أو الحرير.
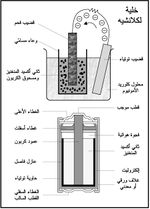
وهي من أشهر أنواع الخلايا الأولية primary cells تستخدم مرة واحدة، وبالتالي فهي غير قابلة للشحن rechargeable، ويعود الفضل في ابتكارها إلى العالم الفرنسي لكلانشيه عام 1860، وهي تولد جهداً بين قطبيها يساوي 1.5 فولط، ويظهر في (الشكل-1) بنيتها بشكليها القديم والحديث، وهي تشتمل على قضيب من الفحم وآخر من التوتياء وعلى معجون كلوريد الأمونيوم ومعجون من ثاني أكسيد المنغنيز ومسحوق الكربون يحيط بقطبها الموجب. وتسمى أيضاً بسبب تركيبها هذا خلية الكربون – خارصين.
يمكن وصف ذلك بتراكم فائض من الإلكترونات السلبية في الزنك الذي يتخذ بذلك شحنة سلبية. فإذا أوصلنا بسلك معدني بين الشرحتين انطلقت من الزنك بتأثير المحلول الكترونات نحو النحاس وهذا الانتقال للإلكترونات يحدث تيار كهربائي. تستمر هذه الظاهرة ما دام مفعول الأحماض على الشريحتين المعدنيتين باق.
يعني ذلك أن التيار الكهربائي هو تحول الطاقة الكيميائية التي تتحرر من ردود الفعل التي تحدث داخل البطارية, وتتوقف كمية الكهرباء التي تعطيها البطارية على كمية المادة التي تتحول فيها.
على هذا الأساس العلمي تم تصنيع البطارية الكهربائية الجافة لكن الأقطاب لم تعد تغمس في سائل, حيث يتكون العمود الموجب فيها من قضيب من الفحم يحيط به بيوسيد المنكنيز والقطب السالب عبارة عن أنبوب من الزنك يحتوي على كلورور النشادر المعجون بالجيلاتين.
تعطي البطارية الجافة جهدا كهربائيا مقداره 1,5 فولت. وتتوفر بقدرات مختلفة,وهناك بطاريات مصنوعة من النيكل كادميوم يمكن إعادة شحنها مرات عديدة, وهذا النوع من البطاريات تكون بجهد 1,2 فولت.
| Diagram | Size | Capacity (mA·h) | Voltage | Energy, theoretical (J) | ANSI/NEDA | IEC | Diam. (mm) | Mass (g) | Height (mm) | Length (mm) | Width (mm) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| AAAA | 625 | 1.5 | 3375 | 25A | LR8D425 | 8.3 | 6.5 | 42.5 | cylindrical | cylindrical | |
 |
N | 1000 | 1.5 | 5400 | 910A | LR1 | 12 | 9 | 30.2 | cylindrical | cylindrical |
 |
AAA | 1250 | 1.5 | 6750 | 24A | LR03 | 10.5 | 11.5 | 44.5 | cylindrical | cylindrical |
 |
AA | 2850 | 1.5 | 15390 | 15A | LR6 | 14.5 | 23 | 50.5 | cylindrical | cylindrical |
| J | 625 | 6 | 13500 | 1412A | 4LR61 | prismatic | 30 | 48.5 | 35.6 | 9.18 | |
| 9V | 625 | 9 | 20250 | 1604A | 6LR61 | prismatic | 45.6 | 48.5 | 26.5 | 17.5 | |
 |
C | 8350 | 1.5 | 45090 | 14A | LR14 | 26.2 | 66.2 | 50 | cylindrical | cylindrical |
 |
D | 20500 | 1.5 | 110700 | 13A | LR20 | 34.2 | 148 | 61.5 | cylindrical | cylindrical |
| Lantern | 26000 | 6 | 561600 | 915A | 4R25Y | prismatic | 885 | 112 | 68.2 | 68.2 | |
| Lantern | 26000 | 6 | 561600 | 908A | 4LR25X | prismatic | 885 | 115 | 68.2 | 68.2 | |
| Lantern | 52000 | 6 | 1123200 | 918A | 4LR25-2 | prismatic | 1900 | 127 | 136.5 | 73 |
فهرست
كيفية عملها
نتيجة لمناقشات عديدة بين العالم فولتا والعالم جلفاني (Galvani) تبين أنه بتوصيل معدنين مختلفين ببعضهما ينتج قوة كهربائية مولدة من شأنها أن تبقي المعدنين على جهد مختلف, ألا أن هذا الفرق لا يمكنه أن يعطي تيارا بكمية يعتد بها وذلك لعدم توفر احتياطي من الطاقة لتغذيته, وتبين له أن غمس شريحتين من معدنين مختلفين مثل (النحاس والزنك) في موصل من نوع آخر مثل محلول من الماء يمكن أن يحدث طاقة كافية للإبقاء على الفارق بالجهد بين المعدنين لفترة معينة تسمح لمرور تيار, حيث يحدث بين الشريحتين المعدنيتين فارق بالجهد يقدر بحوالي فولت واحد إذ أن جهد النحاس أكبر من جهد الزنك.
يؤدي غلاف الخلية الذي يصنع من التوتياء دور القطب السالب للخلية، في حين يشكل قضيب الفحم قطبها الموجب. أما معجون كلوريد الأمونيوم فيؤدي دور المحلول الكهرليتي الكهربائي. وأما ثاني أكسيد المنغنيز الذي يحيط بقضيب الفحم فيستخدم لمنع استقطاب الخلية، أي أنه مزيل لاستقطابها حيث أنه يمنع تشكل غمد من غاز الهدروجين حول قضيب الفحم، يحول دون استمرار التفاعل الكيميائي، وإذا حدث ذلك توقف تدفق التيار الكهربائي في الدارة.
يعود السبب في كون الجهد المتولد بين قطبي الخلية الجافة مساوياً 1.5 فولط، إلى أن الفحم معدن سالب كهربائياً electronegative، وهو يكتسب شحنة موجبة في المعجون الكيميائي المذكور عند التوازن يقارب 1 فولط، في حين يكتسب التوتياء الموجب كهربياً electropositive المغمور في المعجون الكهرليتي عند التوازن جهداً كهربائياً سالباً مقــداره -0.51 فولط. وهكذا يكون فرق الكمون بين قطبي الخلية الجافة مساوياً حاصل طرحهما أي [1- (-0.51)] أو 1.51 فولط.
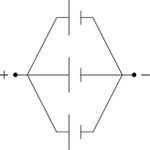
غالباً ما تجمع الخلايا الجافة على التسلسل للحصول على جهود كهربائية أعلى، كما قد تجمع على التفرع للحصول على تيارات كهربائية أشد. ويظهر في (الشكل-2) رسم رمزي يبين كيفية جمع الخلايا على التسلسل، وفي (الشكل-3) كيفية جمعها على التفرع أو على التوازي.
تجدر الإشارة أخيراً إلى أن كبر حجم الخلية الجافة لا يغير من الجهد الكهربائي المتولد بين قطبيها، وكل ما يفعله ذلك هو زيادة عمر الخلية، ومتى نفدت المواد الكيميائية التي تتركب منها تفقد الخلية فائدتها. وهي تغدو كذلك إذا زادت مقاومتها الداخلية بحيث تعجز عن تقديم التيار اللازم لتشغيل الحمل الموصول بها. فإذا فرضنا E الجهد بين طرفي الخلية الجافة من دون حمل load، وإذا أضحى الجهد بين طرفيها عند ربط الحمل ذي المقاومة R مساوياً V، وإذا فرضنا I شدة التيار المار في الحمل عندئذ يكون لدينا:
E = I (r + R)
ويكون:V = IR
ومنهما نجد:
E – V
R
=
r
V
وهي تعطي المقاومة الداخلية للخلية الجافة والتي إذا زادت على حد معين أضحت من دون فائدة.
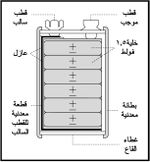
تستخدم الخلايا الجافة على نطاق واسع في تشغيل أجهزة الراديو والأجهزة الإلكترونية المحمولة، وتأخذ أبعاداً مختلفة. كما تجمع أحياناً على التسلسل بحيث تشكل كتلة واحدة تولد جهداً كهربائياً يساوي 4.5 فولط أو غير ذلك كما هو واضح في (الشكل-4)، ويطلق عليها عندئذ اسم مدخرة أو بطارية battery.[2]
أنظرأيضاً
- Battery (vacuum tube)
- AA battery
- AAA battery
- AAAA battery
- C battery
- D battery
- Alkaline battery
- Battery Directive
- Battery holder
- Battery isolator
- Battery recycling
- Battery terminals
- Car battery
- Galvanic cell
- Flexible battery
- Electrochemical cell
- Energy density
- Energy storage
- Lead-acid battery
- List of battery sizes
- List of battery types
- Magnetic battery
- Nano titanate
- Nanowire battery
- PP3 battery, also known as “9-volt”
- Printed battery
- Recharging batteries
- Replacing batteries
- Thermal runaway
- Trickle charging
- Watch battery
مصادر