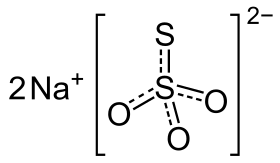
ثيوكبريتات الصوديوم
| ثيوكبريتات الصوديوم | |
|---|---|
|
|
|
| الاسم النظامي (IUPAC) | |
|
ثيوكبريتات صوديوم |
|
| أسماء أخرى | |
|
هيبوكبريتيت الصوديوم |
|
| المعرفات | |
| رقم CAS | 7772-98-7 |
| بوب كيم | 24477 |
| كيم سبايدر | 22885 |
| المكون الفريد | L0IYT1O31N |
| رقم المفوضية الأوروبية | 231-867-5[1] |
| ECHA InfoCard ID | 100.028.970 |
| ZVG number | 2480 |
| الكيانات الكيميائية للأهمية البيولوجية | 132112[2] |
| ChEMBL | CHEMBL2096650 |
| رقم RTECS | XN6476000 |
| ك ع ت | V03AB06 |
| مرجع بايلشتاين | 11323704 |
|
|
|
| الخواص | |
| صيغة جزيئية | Na2S2O3 |
| الكتلة المولية | 158.09 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 1.66 غ/سم3 |
| نقطة الانصهار | 48.3 °س |
| الذوبانية في الماء | ينحل بشكل جيد |
| المخاطر | |
| توصيف المخاطر |
لا يوجد
|
| تحذيرات وقائية |
لا يوجد
|
| NFPA 704 | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل |
|
ثيوكبريتات الصوديوم هو مركب كيميائي له الصيغة Na2S2O3، لكنه يتواجد غالباً بالشكل البلوري Na2S2O3.5H2O حيث يتساند مع خمس جزيئات من الماء. بلوراته بيضاء، منحلة بالماء بشكل كبير. يمتاز هذا المركب بخواصه المرجعة لذلك يدخل في العديد من التطبيقات.
التحضير
من أكثر الطرق أهمية في تحضير هذا المركب هي التفاعل المباشر بين كبريتيت الصوديوم والكبريت الحر.
طريقة أخرى للتحضير تعتمد على تمرير غاز ثاني أكسيد الكبريت على محلول ممدد من كبريتيد الصوديوم وكربونات الصوديوم (ليس أكثر من 10% لكليهما).
الاستخدامات
- يستخدم كمادة مضادة للـكلور بعد عملية قصر(تبييض) منتجات الـسيليلوز.
- يستخدم في التصوير الضوئي وذلك لإذابة مركبات هالوجينات الفضة الغير متأثرة وذلك من النسخ السالبة (negatives)، حيث يدعى بالاسم الشائع “هيبو hypo“.
- يستخدم كمادة حافظة ضد التخمر في الصباغة، كما بدخل في تركيب المواد المثبتة للصباغ.
بلورات ثيوكبريتات الصوديوم
المصادر
- ^ مذكور في : معرف المكون الفريد — معرف المكون الفريد: http://fdasis.nlm.nih.gov/srs/srsdirect.jsp?regno=L0IYT1O31N — تاريخ الاطلاع: 19 نوفمبر 2016 — المحرر: إدارة الأغذية والأدوية — العنوان : sodium thiosulfate anhydrous
- ^ مذكور في : الكيانات الكيميائية للأهمية البيولوجية — معرف ChEBI: https://www.ebi.ac.uk/chebi/searchId.do?chebiId=CHEBI:132112 — تاريخ الاطلاع: 12 أكتوبر 2016 — العنوان : sodium thiosulfate — الناشر: معهد المعلوماتية الحيوية الأوروبي — الرخصة: CC BY 3.0 Unported
- مذكور في : بوب كيم — https://pubchem.ncbi.nlm.nih.gov/compound/24477 — تاريخ الاطلاع: 19 نوفمبر 2016 — العنوان : SODIUM THIOSULFATE — الرخصة: محتوى حر
shreve´s chemical process industries, fifth edition, ISBN 0-07-057147-3