
أس هيدروجيني
من ويكيبيدي
دليل شوارد الهيدروجين (الأس الهيدروجيني أو الرقم الهيدروجيني أو درجة الحموضة أو باهاء
) ويرمز لها بالرمز pH هي القياس الذي يحدد ما إذا كان السائل حمضياً أم قاعدياً أم متعادلاً. تعدّ السوائل ذات درجة حموضة أقل من 7 أحماض وتعدّ السوائل ذات درجة حموضة أعلى من 7 محاليل قلوية أو قواعد. أما درجة الحموضة 7 فهي تعدّ متعادلة وهي تساوي الأس الهيدروجيني للماء النقي عند درجة حرارة 25 مئوية. ويمكن معرفة درجة حموضة أي محلول باستخدام مؤشر الرقم الهيدروجيني.
درجة الحموضة (يسمونها أحيانا الأس الهيدروجيني) هي سالب لوغاريثم العشري لتركيز أيون الهيدروجين في محلول ما ويشير الي درجة حموضة ذلك المحلول، ويمكن قياسه عن طريق مؤشر الأس الهيدروجيني.
يمكن تتبع مقياس الرقم الهيدروجيني لمجموعة من المحاليل القياسية التي يتم تحديد درجة حموضتها من خلال اتفاق دولي. يتم تحديد القيم القياسية لرقم الهيدروجيني الأساسي باستخدام خلية تركيز مع التحول، من خلال قياس الفرق المحتمل بين القطب الهيدروجيني والقطب القياسي مثل قطب كلوريد الفضة. يمكن قياس الرقم الهيدروجيني للمحاليل المائية بقطب زجاجي ومقياس درجة الحموضة أو مؤشر.
تعريف الباهاء pH الرياضي
يستخدم القانون اللوغاريتمي لتحديد قيمة الأس الهيدروجيني pH ، وهي قيمة بدون وحدات: p H = − log 10 a H = log 10 1 a H {\displaystyle \mathrm {pH} =-\log _{10}a_{\mbox{H}}=\log _{10}{\frac {1}{a_{\mbox{H}}}}}
حيث aH يمثل الفاعلية الكيميائية لأيونات الهيدروجين.
كما تُعرف صياغات أخرى نجدها في مختلف الكتب والمقالات: p H = − log 10 ( a H + ) {\displaystyle \mathrm {\!\ pH=-\log _{10}({a_{H^{+}}})\ } } 
وكل تلك الصياغات صحيحة.
بالنسبة إلى المحاليل المخففة يعادل الباهاء pH اللوغاريتم السالب (في النظام العشري) لتركيز (c) أيونات الهيدروجين (H3O+) بوحدة مول/لتر، وتسمى أيونات الهيدروجين الموجبة الشحنة أحيانًا أيون الأوكسونيوم Oxonium : p H = − log 10 ( c H 3 O + ⋅ l i t e r m o l ) {\displaystyle \mathrm {\!\ pH=-\log _{10}\left({c_{H_{3}O^{+}}}\,\cdot {\frac {liter}{mol}}\right)} } 
تاريخه
أدخل العالم الدانمركي سورين سورينسن عام 1909 أس أيون الهيدروجين لحساب قيمة pH+ لتركيز أيونات الهيدروجين Cp=10−pH+
وكان يعين القيم pH+ بواسطة قياسات كهربية. ثم أصبحت طريقة كتابة pH+ هي السائدة حتى وقتنا الحاضر لقيمة pH. وقد استخدم سورنسن حرف H للتعبير عن أيونات الهيدروجين، كما استخدم حرف p عشوائيًا كمؤشر لقياساته على السوائل.ثم تحول الحرف p في pH إلى كلمة Potenz بمعني قوة أو أس ‘وبعد ذلك أدخلت فاعلية أيون الهيدروجين للتعبير عن مقياس الهاباء. وهي تعتمد على طريقة قياس معينة يجب اتباعها وتستخدم محاليل مرجعية ذات مواصفات ثابتة، ومنها أصبح قياس قيمة pH محددًا لجميع المختبرات.
وتتيح تلك الطريقة للقياس اتقان القياس وثبات القيم عند إعادة القياسات، وهي تتيح في نفس الوقت إمكانية مقارنة محاليل مختلفة بدقة.
وعند الحديث عن أيونات الهيدروجين (H+) أو أس أيونات الهيدروجين في محلول فيعود ذلك إلى تفاعل حمض-قلوي طبقًا لأرهنيوس. أما في وقتنا الحاضر فأصبحنا نستخدم تفاعل حمض-قاعدة طبقًا ” لبرونستد” ، وكذلك استخدام أيون الأوكسونيوم (H3O+، وهو أيون يتكون من جزيء ماء بعد تفاعله مع عاطي بروتون يأخذ منه بروتونًا، فيصبح تركيب هذا الجزيء 1 أكسجين و3 هيدروجين، بالمقارنة بجزيء الماء المتكون من 1 ذرة أكسجين و2 هيدروجين. ويعدّ جزيء الماء هذا آخذ بروتون حيث انتزع بروتونًا من عاطي بروتون.
حساب pOH
مثلمًا قمنا بحساب أس الهيدروجين فيعرف أيضًا أس الهيدروكسيد أو القيمة pOH. فهما متعلقان ببعضهما البعض. وقيمة pOH هي سالب أس اللوغاريتم العشري لجزيئات الهيدروكسيد النشطة OH−. ويقاس نشاط OH− بوحدة مول/لتر أيضًا. في نفس الوقت، بيِّنت التجربة أن أيون الهيدروجين (H+) لا يوجد منفردًا في الماء وأنما يقترن بأحد جزيئات الماء ويتكون أيون أوكسونيوم (H3O+) ولكن هذا لا يغير من الأمر شيئًا، ولكن نذكر ذلك بغرض استخدام المعادلات المتاحة الآتية.

مقياس الهاباء pH للتوضيح في المدارس :الأحمر النطاق الحمضي، والأزرق: النطاق القاعدي. ويلاحظ أن p H + p O H = 14 {\displaystyle \mathrm {pH+pOH=14} } 
العلاقة بين pH و pOH
ترتبط فاعليتي الأس الهيدروجيني والأس الهيدروكسيلي بمعادلة التفاعل (تفكك الماء): 2 H 2 O ⇌ H 3 O + + O H − {\displaystyle \mathrm {2\ H_{2}O\ \rightleftharpoons \ H_{3}O^{+}\ +\ OH^{-}} }
هذا تفاعل عكوس ويتميز بثابت توازن : K W = a H 3 O + ⋅ a O H − a H 2 O {\displaystyle \mathrm {K_{W}={\frac {a_{H_{3}O^{+}}\cdot a_{OH^{-}}}{a_{H_{2}O}}}} }
وبأخذ اللوغاريثم للأساس 10 السالب نحصل على: − log 10 K W = − log 10 a H 3 O + − log 10 a O H − + log 10 a H 2 O = p H + p O H {\displaystyle \mathrm {-\log _{10}K_{W}=-\log _{10}a_{H_{3}O^{+}}-\log _{10}a_{OH^{-}}+\log _{10}a_{H_{2}O}=pH+pOH} }
أي أن التركيزان مرتبطان ببعضهما البعض بحيث تكون: log 10 K W = p H + p O H {\displaystyle \mathrm {\log _{10}K_{W}=pH+pOH} } 
ونظرًا لأن نشاط الماء في المحلول المخفف نعتبره 1 ، فيكون لوغاريتمه صفرًا. ونحصل على ثابت التوازن في الظروف العادية لدرجة الحرارة والضغط، أي عند 25 درجة مئوية والضغط الجوي العادي: KW = 10−14
،أي أن العلاقة بين pH وpOH هي: p H + p O H = 14 {\displaystyle \mathrm {pH+pOH=14} }
مقياس – pH
تتفكك بعض جزيئات الماء النقي من ذاته، ويتكوّن أيون أوكسونيوم H3O+ وايون هيدروكسيد (OH−). ويوصف جزئء الماء H2O بأنه يمكن أن يتفاعل كحمض ويكون عاطي بروتون أو أن يتفاعل كقاعدة قلوية ويكون في تلك الحالة آخذ بروتون. 2 H 2 O ⇌ H 3 O + + O H − {\displaystyle \mathrm {2\ H_{2}O\ \rightleftharpoons \ H_{3}O^{+}\ +\ OH^{-}} }
هذا التفاعل هو تفاعل عكوس أي يسير في اتجاهين ويتميز بحالة توازن، ويميل التوازن لصالح الماء. ويبلغ حاصل ضرب تركيز الأيونات لهذا التفاعل عند درجة حرارة 25 درجة مئوية (أو 298 كلفن) نحو 10−14 مول2 لتر−2. ويعتمد هذا التوازن بشدة على درجة الحرارة.
وبسبب تواجد أيونات الماء هذه في الماء يمكن للماء توصيل الكهرباء وإن كانت تلك الخاصية منخفضة.
تعطينا معادلة التفاعل السابقة ثابت التوازن: KW = c(H3O+) · c(OH−) = 10−14 مول2/لتر2
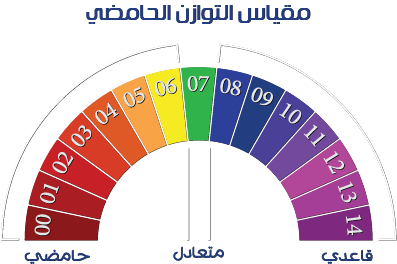
وتنقسم قيم الأس الهيدروجيني pH للمحاليل المخففة إلى:
- pH <7 محلول مائي “حمضي” وتكون –cH3O+> cOH
- pH == 7 محلول مائي متعادل cH3O+ == cOH; وهي صفة الماء النقي،
- pH> 7 محلول مائي قلوي وتكون cH3O+ <cOH
طرق قياس pH
تستخدم عدة طرق لتعيين الباهاء.
الفلتمتر
تعتمد طريقة معظم الأجهزة المستخدمة على طريقة الفولتمتر. وفيها تُملأ كرة غشائية زجاجية بمحلول منظم وتغطس في المحلول المراد قياسه. ونظرا لميول أيونات الهيدروجين للالتصاق بالطبقة الرقيقة من السيليكات لسطح الزجاج ينشأ جهد كهربائي بحسب فرق الPH بين داخل وخارج الكرة الزجاجية. وتقاس تلك القوة الدافعة الكهربائية بواسطة قطبين مرجعيين، أحدهما داخل الكرة الزجاجية والآخر خارجها في محلول العينة المراد قياس الPH لها. (أنظر إلكترود pH.
مقحل حقلي حساس
عمل المقحل الحقلي يشبه عمل قطب الكرة الزجاجية. تتراكم أيونات الهيدروجين على السطح الحساس لغشاء المدخل Gate Membran للمقحل ISFET فينشأ جهد كهربائي عليه، مما يغير مرور التيار الكهربائي في الترانسيستور. ويمكن تحويل ذلك التغير في التيار إلى إشارة كهربية بواسطة جهاز مناسب بحيث تعطي قيمة الPH مباشرة.
تعيين الPH بكاشف لوني
يمكن تعيين الأس الهيدروجيني لمحلول بواسطة استخدام طريقة مقارنة اللون تستخدم فيها كواشف لونية.(أنظر مؤشر الأس الهيدروجيني)
أهمية الأس الهيدروجيني في الإنسان
يكون نطاق وجود PH في دم الإنسان وفي باقي سوائل الخلايا محدودًا. ويضبط PH في الدم عن طريق نظام معقد من ثاني أكسيد الكربون الذائب ومن أملاح وبروتينات ، وهي تسمى محلول منظم دموي. وفي الدم الشرياني تكون قيمة الباهاء بين 7,35 – 7,45. وتؤثر قيمة PH في الدم على الهيموجلوبين: كلما انخفضت قيمة PH كلما نقصت كمية الأكسجين التي يمكن للدم احتواءها (تأثير بور). فإذا انخفض حمض الكربونيك أثناء التنفس في الدم فإن الهموجلوبين يفصل أكسجين. وعندما يحدث العكس، عندما يخرج ثاني أكسيد الكربون من الرئتين ترتفع قيمة PH في الدم وبالتالي ترتفع قابلية الهموجلوبين لأحتواء أكسجين.
كذلك PH أهمية بالنسبة لتناسل الإنسان. فبينما تكون سوائل المرأة حمضية لقتل البكتريا الضارة يكون سائل الحيوان المنوي قلوي. ويحدث تعادلهما أثناء الجماع الجنسي فتكون الظروف ملائمة لحركة الحيوانات المنوية للبحث عن البويضة وتخصيبها.
كما أن بشرة الإنسان تكون حمضية قليلًا حيث يكون الأس الهايدروجيني 5.5 ويقي ذلك الغطاء (العرق) الحمضي من البكتيريا الضارة. وعند استخدام الصابون وهو يكون عادة قاعدي وبعد التجفيف فهذا يبعد الطبقة الدهنية والطبقة الحمضية الواقية.
تصنع مستحضرات الغسيل من مخلوط ماء وجلسرين وملح الطعام وثيوسلفات الصوديوم وبيكربونات الصوديوم ، وقليل من مؤثر سطحي (تنسيد Tenside)، وتضبط كمياتها بحيث يكون PH لها في حدود 5.
تأثير قيمة الPH على نمو النبات
تؤثر قيمة الباهاء في الأرض الزراعية على توفر أملاح النمو للنبات. وعندما تكون الأرض قلوية أو متعادلة تتكون فيها أملاح أكسيد هيدروكسيد الحديد التي لا يمتصها النبات فتحدث له فقرًا في الحديد. وإذا تغيرت قيمة الباهاء في الأرض تغيرًا كبيرًا فيمكن أن يؤثر ذلك سلبيًا على وظائف أعضاء النبات.
ومن المكونات الغذائية في النباتات نجد النيتروجين وبعض العناصر الأخرى. ويحصل النبات على النيتروجين من أيونات الأمونيوم الذائبة (NH4+) أو من أيونات النترات (NO3−). نترات الأمونيوم تكون في الأرض في وسط متعادل (باهاء = 7). وعندما تكون الأرض حمضية تزيد فيها أيونات الأمونيوم NH4+، أما في الأرض القلوية فتزيد فيها أيونات النترات NO3−.
إذا كانت أغشية جذور النبات نفاذة لأيونات الأمونيوم NH4+ فإنها تكون محتاجة لأرض حمضية. وتحتاج لأخذ أيون النترات NO3− من أرض قلوية للنمو. وتقل حساسية النبات لهاباء الأرض إذا كانت أغشيتها نفاذة لكلا من الأمونيوم والنترات. ويستخدم نترات الأمونيوم (NH4NO3) في السماد الصناعي حيث يوجد فيه نوعي أيونات الأمونيوم والنترات.
وطبقًا لقيمة الباهاء في التربة تختلف إمكانية النبات لأخذ موادها الغذائية، فإذا كانت قيمة الباهاء مرتفعة أو منخفضة فهذا يحد من أمكانيتها لامتصاص المواد الغذائية. وعندما يكون الباهاء منخفضًا يزداد ذوبان أيونات (أملاح) الألمونيوم والمنجنيز وقد يصل تركيزها إلى حد ضار للنبات.


ــــــــــــــــــــــــــــــــــــــــــــ

دليل شوارد الهيدروجين (الأس الهيدروجيني أو الرقم الهيدروجيني أو درجة الحموضة أو باهاء) ويرمز لها بالرمز pH هي القياس الذي يحدد ما إذا كان السائل حمضياً أم قاعدياً أم متعادلاً. … تعدّ السوائل ذات درجة حموضة أقل من 7 أحماض وتعدّ السوائل ذات درجة حموضة أعلى من 7 محاليل قلوية أو قواعد.

- الفلتمتر تعتمد طريقة معظم الأجهزة المستخدمة على طريقة الفولتمتر. …
- مقحل حقلي حساس عمل المقحل الحقلي يشبه عمل قطب الكرة الزجاجية. …
- تعيين الPH بكاشف لوني يمكن تعيين الأس الهيدروجيني لمحلول بواسطة استخدام طريقة مقارنة اللون تستخدم فيها كواشف لونية.(أنظر مؤشر الأس الهيدروجيني)
قياس الأس الهيدروجيني – دليل نظرية الأس الهيدروجيني
دليل إلى قياس الأس الهيدروجيني – نظرية تطبيقات الأس الهيدروجيني المعملية
تعتمد قياسات الأس الهيدروجيني الصحيحة والدقيقة على أقطاب وأدوات موثوقة. ويعد اختيار الأجهزة المناسبة ومعالجتها وصيانتها ضروريًا للحصول على نتائج أمثل ولإطالة عمر الأجهزة.
تعتمد قياسات الأس الهيدروجيني الصحيحة والدقيقة على أقطاب وأدوات موثوقة. ويعد اختيار الأجهزة المناسبة ومعالجتها وصيانتها ضروريًا للحصول على نتائج أمثل ولإطالة عمر الأجهزة.
يركز دليل نظرية الأس الهيدروجيني هذا على تقديم وصف واضح وعملي حول كيفية قياس الأس الهيدروجيني في المختبر وبيئة العمل الميداني. وتم ذكر الكثير من النصائح والتلميحات حول النقاط المهمة ووصف القياس بالكامل فيما بعد مدعومة بالوصف النظري لقياسات الحموضة والقلوية. وتم أيضًا تسليط الضوء على الأنوع المختلفة للأقطاب الكهربائية للأس الهيدروجيني ومعايير محددة لاختيار القطب الكهربائي الصحيح المناسب
لعينة محددة.
ــــــــــــــــ
مقياس الرقم الهيدروجيني pH كتيّب البيانات-ما هي القيمة pH؟
ما هي قيمة pH؟
تُستخدَم قيمة pH كمقياس معياري لقياس خصائص الماء. وهي تُقرأ باللغة الإنجليزية “بي إتش”، وباللغة الألمانية “بيه ها”. ومن الناحية العلمية، تعبّر قيمة pH عن مقدار تركيز أيونات الهيدروجين (H+) في سائل ما. إذا كان تركيز أيونات الهيدروجين (H+) في السائل مرتفعًا، فإنه يكون حمضيًا. وإذا كان التركيز منخفضًا، فإنه يكون قاعديًا (قلويًا). وهذا يعني أنه عند قياس تركيز أيونات الهيدروجين يمكن معرفة مقدار الحموضة والتعادل والقلوية، وكذلك درجة كل منها. ولقيمة pH مقياس من 0 إلى 14، حيث القيمة 7 هي المستوى المتعادل وأي قيمة أقل من 7 تزيد مستوى الحمضية مع انخفاض القيمة، وأي قيمة أعلى من 7 قلوية وتزداد القلوية مع تزايد القيمة. السوائل ذات المذاق المرّ مثل الخل والعصير وصودا الغسيل (الغسول القلوي أو الرماد المذاب في الماء) قلوية. التعادل (pH 7) يعني أن تركيز أيونات الهيدروجين هو 10 مرفوعة للقوة ناقص 7 (0.0000001) جزيء جرامي لكل لتر. على سبيل المثال، في إنتاج الأطعمة، تُستخدَم إضافات الطعام المعدِّلة لقيمة pH (حمض السيتريك، سيترات الصوديوم الثلاثي، إلخ) على نطاق واسع وتلعب دورًا مهمًا في الحفاظ على جودة الأطعمة. للكائنات العضوية المجهرية قيمة pH مثالية للتكاثر، ويختلف حدّ الـ pH للحمضية والقلوية للتكاثر لكل نوع من الكائنات العضوية المجهرية. مستوى pH المثالي لغالبية الكائنات العضوية المجهرية هو من 7 إلى 8 (متعادل أو قلوي قليلاً)، وإذا كان مستوى pH خارجًا عن هذا النطاق فسيتم كبح انتشار وتكاثر الكائنات العضوية المجهرية.
وبالنسبة للتربة فإن مستوى pH الملائم لزراعة المحاصيل هو عادة 6.5 (حمضي قليلاً)، لكن هناك بعض المحاصيل التي تفضل بيئة متعادلة أكثر قلوية ومحاصيل أخرى تفضل الحمضية. في قطاع التصنيع، تُعدّ قيمة pH المقياس المعياري لمنع تلف الزيت، ومن الضروري قياس قيمة pH لمنع إصابة مواد العمل بالصدأ. مستوى pH لمادة التبريد السائلة يكون عادة أعلى من 9 عندما يكون الزيت طازجًا (جديدًا). وبمجرد أن يبدأ التلف ينخفض مستوى pH، لكن قيمة pH المثالية للزيت ينبغي أن تظل أعلى من 8.5. وعندما تنخفض قيمة pH عن 8، تنتشر البكتيريا وتتكاثر وتسبّب التلف.
استخدام قيمة pH أصبح يكتسب أهمية في تشكيلة واسعة من المجالات – من الصناعة والصناعات الغذائية إلى التربة والأنهار.












